Chemia szkła
Głównym składnikiem szkła płaskiego jest SiO2 (krzemionka).
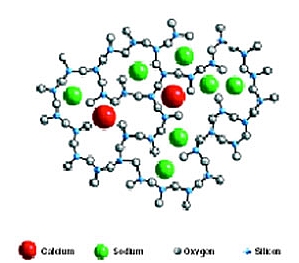
Charakteryzuje się ona wysoką temperaturą topnienia wynoszącą około 1700 stopni Celsjusza, a jej stan skupienia w tej temperaturze przypomina konsystencję syropu w bardzo zimny dzień. Podstawowy element krzemionki ma kształt czterościennej piramidy (tetraedru) z atomem krzemu znajdującym się w środku, symetrycznie połączonym z czterema atomami tlenu znajdującymi się w rogach; jego chemiczna formuła to SiO4 i jest on naładowany ujemnie.
W trakcie szybkiego schładzania stopionej krzemionki, tworzy się statystycznie nieuporządkowana więźba tetraedrów, połączonych w rogach wspólnymi jonami tlenu, co daje materiał amorficzny zwany szkłem krzemionkowym.
Podstawowe reakcje chemiczne
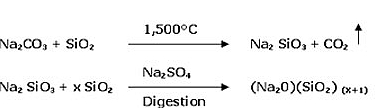
Ze względów praktycznych i ekonomicznych, wysoka temperatura topnienia i lepkość krzemionki obniżana jest poprzez dodanie tlenku sodu (topnika) w formie węglanu. Atomy tlenku sodu wchodzą do więźby krzemo-tlenowej, zgodnie z ich wartościowością. Atomy te znane są jako składniki szkieleto-twórcze. Inne główne składniki szkła płaskiego to wapień i magnez. Wchodzą one do struktury szkieletowej jako modyfikatory więźby szklistej. Ich zadaniem jest tworzenie struktury bardziej kompleksowej tak, aby kiedy wszystkie składniki razem uległy stopieniu, w procesie chłodzenia trudniejsze było uzyskanie konfiguracji atomów, która umożliwiałaby krystalizację.
W procesie produkcji szkła, szybkość chłodzenia jest tak dobrana, aby wzrastała lepkość, a ruchliwość atomów była powstrzymywana w celu zapobieżenia krystalizacji.
Dlatego też szkło często określane jest jako przechłodzona ciecz, w której nie występuje krystalizacja oraz nie ma punktu topnienia, i nie wykazuje ono zjawiska ciepła utajonego krystalizacji lub topnienia.
Struktura szkła sodowo-wapniowo-krzemianowego